

О ЗАБОЛЕВАНИИ
Истинная полицитемия относится к большой группе гематологических заболеваний, именуемых – Хронические миелопролиферативные новообразования (ХМПН). ИП сопровождается продукцией избыточного количества эритроцитов.
Основная причина ИП до сих пор не выявлена. Однако достоверно известно, что у 97-98% больных ИП выявляeтся изменениe (мутация) в гене JAK2 (сокращенное от Янускиназа-2). Данная мутация известна как JAK2V617F. У оставшихся 2-3% больных ИП выявляется мутация в том же гене, но другом участке (12-й экзон гена JAK2).
Человек не рождается с вышеуказанными мутациями, они возникают в процессе жизни. Вы должны понимать, что ИП это не наследственное заболевание. При этом в литературе описаны семейные случаи ХМПН.
Кроме вышеописанных мутаций, в механизме развития ИП принимает участие целый ряд нарушений на генетическом уровне. В медицинской литературе вы можете прочитать о JAK-STAT – сигнальном пути, активация которого приводит к неконтролируемому росту клеток.
ИП довольно редкое заболевание. Заболеваемость ИП в мире составляет 1-1,9 на
100 000 населения.
Механизм развития Истинной полицитемии
Для того, чтобы лучше понять, как развивается ИП и как заболевание влияет на Ваш организм, необходимо изучить некоторые понятия.
Система кроветворения – это комплекс органов и тканей, благодаря которым в организме образуются, работают и разрушаются клетки крови. Важнейшее место в этой системе занимает костный мозг.
Костный мозг – это мягкая пористая ткань внутри костей, в которой образуются стволовые кроветворные клетки (их также называют гемопоэтические стволовые клетки), в дальнейшем развивающиеся в зрелые клетки крови. Зрелые клетки в дальнейшем попадают в сосуды, где начинают выполнять свою основную функцию.
К зрелым клеткам крови относятся: эритроциты, лейкоциты и тромбоциты. Эритроциты (красные кровяные тельца) отвечают за транспорт кислорода к тканям организма; лейкоциты (белые кровяные тельца) обеспечивают иммунитет и противостоят инфекциям, тромбоциты (кровяные пластинки) участвуют в свертывании крови и препятствуют кровотечениям.
Истинная полицитемия сопровождается образованием избыточного количества в первую очередь эритроцитов, что делает кровь более густой. Такое состояние крови создает условия для образования сгустков (тромбов). Кроме того, повышенная густота крови препятствует нормальному кровотоку и обеспечению органов и тканей кислородом.
Также ИП сопровождается увеличением размеров селезенки (спленомегалией). Селезенка увеличивается от того, что берет на себя кроветворную функцию костного мозга. Так в селезенке образуются очаги кроветворения, и она увеличивается. Реже может встречаться и увеличение печени (гепатомегалия).
Является ли ИП опухолью? Долгое время данный вопрос был причиной споров между учеными. Однако, так как ИП сопровождается неконтролируемым ростом клеток, это заболевание всё-таки принято относить к группе опухолевых. Есть три основных осложнения заболевания, которые могут нести угрозу жизни. Это тромбозы, развитие миелофиброза (замещение клеточного костного мозга некроветворной тканью) и переход в острый лейкоз (острое, злокачественное течение болезни).
В дебюте заболевания тромбозы встречаются у 12-39% больных ИП. Вероятность исхода в миелофиброз составляет около 0,5% в год среди всех пациентов.
Вероятность исхода в острый лейкоз всего 0,34% от общего числа больных в течение первых 5 лет заболевания и 1,1% при продолжительности болезни более 10 лет.
Основные симптомы ИП
На ранних этапах, ИП может протекать без каких-либо симптомов. Зачастую первым проявлением болезни может быть образование тромба (тромбоз). Тромбы могут образоваться как в артериях, так и в венах.
К основным симптомам, которые могут иметь место при ИП, относятся: слабость, кожный зуд, ночная потливость, боли в костях, тяжесть или боли в левом подреберье (связаны с увеличением селезенки), повышение температуры, потеря веса.
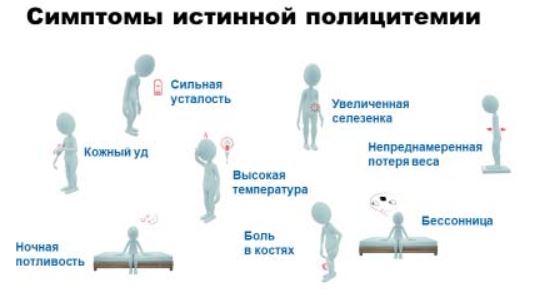
Наличие того или иного симптома, а такцже степени выраженности симптомов у каждого пациента индивидуальны.
Для удобства пациентов и лечащего врача разработан специальный опросник МПН10, предназначенный для оценки симптомов. Он поможет оценить влияние симптомов на Ваше состояние и обсудить с лечащим врачом.

Обследование при Истинной полицитемии
Для правильной поставки диагноза и определения тактики лечения необходимо полное клинико-гематологическое обследование пациента.
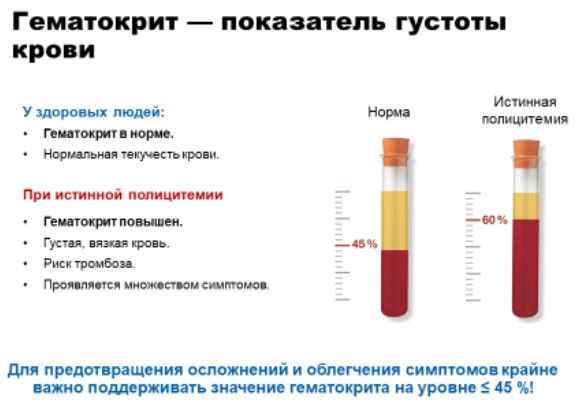
Клинический анализ крови - исследование, которое позволяет определить количество клеток крови (эритроциты, лейкоциты, тромбоциты), степень густоты крови (гематокрит), а также определить наличие молодых форм клеток в лейко-формуле.
Наиболее часто причиной направления пациента для обследования по поводу ИП, является повышение уровня гемоглобина и эритроцитов. И как результат – повышение гематокрита. Кроме того, с течением заболевания, в общем анализе крови также отмечается повышение лейкоцитов и тромбоцитов
Биохимический анализ крови - определение биохимических параметров, являющихся показателями состояния органов и систем организма (печень, почки, обмен железа). Важным показателем является исследование уровня эндогенного эритропоэтина – естественного стимулятора выработки клеток эритроидного ряда.
Морфологическое и гистологическое исследование костного мозга (пункция и трепанобиопсия костного мозга) – исследование, благодаря которому можно оценить состояние кроветворения. Гистологическое исследование является обязательным при постановке диагноза ИП. Кроме того, может возникнуть повторная необходимость в нем при дальнейшем развитии заболевания, для выявления прогрессирования в фиброз. Только благодаря этому исследованию возможна комплексная оценка всех ростков кроветворения, а также выявление наличия фиброза в костном мозге. Процедура получения материала называется трепанобиопсией. Довольно часто пациенты отказываются от исследования из-за страха перед болью.
Молекулярно-генетическое исследование периферической крови на наличие мутации JAK2. Выявление данной мутации является одним из подтверждающих факторов диагноза ИП. Забор крови для данного исследования производится из вены.
Основные методы лечения ИП
Лечение ИП направлено на подавление болезни, профилактику осложнений и улучшение качества жизни пациента. Достигается это путем снижения густоты крови, уменьшения количества избыточных клеток.
Для профилактики тромбозов, в первую очередь необходимо постараться максимально уменьшить влияние факторов, провоцирующих сердечно-сосудистые осложнения. Важным элементом в структуре профилактики тромбозов является поддержание здорового образа жизни (отказ от курения, предупреждение и лечение ожирения, сахарного диабета, артериальной гипертензии).
Одной из главных целей при лечении ИП является поддержание нормального объема крови и её густоты. Одним из способов достижения этой цели является кровопускание. С помощью кровопускания мы достигаем снижения уровня гематокрита. Наилучший уровень гематокрита при ИП не превышает 45%. Благодаря снижению густоты крови уменьшается риск развития тромбозов. Также после кровопускания отмечается уменьшение интенсивности головных болей, снижение АД. Кровопускание осуществляется путем введения иглы в вену и удаления части крови. После процедуры кровопускания может отмечаться небольшое головокружение. Частота и объем кровопускания определяются лечащим врачом в зависимости от показателей крови. Кроме того, кровопускание может приводить к снижению уровня железа, однако это не требует приема железосодержащих препаратов.
Также существует другой, но похожий способ удаления эритроцитов – аппаратный эритроцитаферез. При этом из крови извлекаются эритроциты с помощью специального аппарата, а другие компоненты крови возвращается пациенту обратно.
Лекарственная терапия
Антиагреганты – препараты, уменьшающие степень густоты крови. Наиболее распространенный препарат при ИП это ацетилсалициловая кислота. Она назначается практически всем пациентам с ИП в дозах от 50 до 150 мг в сутки. На усмотрение вашего лечащего врача также могут назначаться и другие антиагреганты (клопедогрел, дипиридамол).
Антикоагулянты – препараты, обладающие противосвертывающим эффектом. Чаще всего данные лекарства назначаются после состоявшихся тромбозов (инфаркт миокарда, венозный тромбоз), а также после оперативных вмешательств.
Гидроксикарбамид – препарат, направленный на подавление избыточного образования клеток в костном мозге. Способствует уменьшению количества лейкоцитов, тромбоцитов, эритроцитов, а также размеров селезенки. Дозировка и кратность приема гидроксикарбамида определяется лечащим врачом в зависимости от показателей крови.
Кроме того, существуют другие противоопухолевые препараты, обладающие похожим подавляющим воздействием на патологические клетки (меркаптопурин, милеран, цитозар).
Интерферон – иммунный препарат, также влияющий на образование клеток в костном мозге, уменьшение размеров селезенки. При хорошей переносимости и длительном лечении возможно достижение стойкого улучшения показателей.
Ингибиторы янускиназы – это целенаправленные (таргетные) препараты, подавляющие передачу сигнала в выше упомянутом JAK-STAT сигнальном пути, который является важным в развитии ИП. Они приводят к снижению роста клеток, уменьшению размеров селезенки и интенсивности симптомов болезни (повышение температуры, слабость, потливость). Руксолитиниб – это пока единственный ингибитор Янускиназы, зарегистрированный в настоящее время для лечения ИП.
Контроль терапии
В процессе лечения необходимо динамическое наблюдение за Вашим состоянием и лабораторными показателями. Осуществляется это с помощью регулярного обследования, которое включает осмотр гематолога, контроль клинического и биохимического анализов крови, ультразвуковое исследование органов брюшной полости, исследование костного мозга (пункция, трепанобиопсия). При необходимости могут быть назначены дополнительные исследования по другим органам и системам.
В заключении, несколько советов пациентам с Истинной полицитемией:
Коллектив авторов:
Шихбабаева Джарият Исмаиловна – к.м.н., гематолог Московского городского гематологического центра ГКБ имени С.П. Боткина Департамента здравоохранения г. Москвы;
Виноградова Ольга Юрьевна – д.м.н., профессор, Заведующая Московским городским гематологическим центром ГКБ имени С.П. Боткина Департамента здравоохранения г. Москвы – врач-гематолог.
Словарь терминов
Гепатомегалия – увеличение печени.
Костный мозг – мягкая, губчатая ткань в центре кости, продуцирующая белые и красные клетки крови, кровяные пластинки.
Лейкоз – злокачественное опухолевое заболевание крови.
Лейкоциты = белые кровяные тельца = белые клетки крови – клетки, защищающие человека от инфекции.
Миело – приставка, в переводе с греческого означающая «костный мозг».
Спленомегалия – увеличение селезенки.
Стволовые клетки = клетки-предшественники – незрелые молодые клетки костного мозга, которые дают в норме начало всем элементам крови.
Трепанобиопсия – изъятие образца ткани костного организма для изучения под микроскопом. Образец ткани в этом случае называют трепанобиоптатом.
Тромбоз – формирование сгустка крови в кровеносном сосуде (вене или артерии).
Фиброз – замещение здоровых клеток рубцовой тканью.
Циторедуктивная терапия – лечение, направленное на снижение продукции клеток.
КОНТАКТЫ
ЦЕНТРЫ, ОКАЗЫВАЮЩИЕ СПЕЦИАЛИЗИРОВАННУЮ ПОМОЩЬ ПАЦИЕНТАМ С МИЕЛОПРОЛИФЕРАТИВНЫМИ НОВООБРАЗОВАНИЯМИ
г. Москва:
Московский городской гематологический центр ГБУЗ города Москвы Городская клиническая больница имени С.П. Боткина Департамента здравоохранения города Москвы,
Адрес: г. Москва, 2-й Боткинский пр-д, 5.
Тел: +7 (495) 945-43-00
ФГБУ Национальный медицинский центр гематологиии МЗ РФ
Адрес: г. Москва, Новый Зыковский проезд, д. 4а
Тел: +7 (495) 612-45-51
г. Санкт-Петербург:
ФГБОУ ВО ПСПБГМУ им. И.П. Павлова, клиника НИИДОГиТ им. Р.М. Горбачевой.
Адрес: г. Санкт-Петербург, ул. Рентгена, д.12
Тел: +7 (812) 338-62-61
ФГБУ РосНИИГТ ФМБА России
Адрес: г. Санкт-Петербург, ул. 2-Советская, д.16
ФГБУ Национальный медицинский центр им. В.А. Алмазова МЗ РФ
Адрес: г. Санкт-Петербург, ул. Аккуратова, д. 2.
Тел: +7 (812) 702-37-03
Общественные организации:
Всероссийское общество редких (орфанных) заболеваний помогает пациентам с редкими заболеваниями. На сайте организации можно более подробно ознакомиться с деятельностью общества, написать письмо, прочитать журнал по редким болезням - www.rare-diseases.ru
Контакты
Председатель правления - Мясникова Ирина Владимировна
Заместитель председателя - Погосян Неля Сергеевна
Исполнительный директор - Большакова Вера Анатольевна
E-Mail: vooz@bk.ru
Всероссийское общество редких (орфанных) заболеваний
125315, г. Москва, ул. Часовая, д. 24, стр. 2, комн. 27
Всероссийское общество редких (орфанных) заболеваний (ВООЗ) создано в 2012 году по инициативе пациентов, членов их семей и экспертов. К редким или "орфанным" заболеваниям в России относят болезни с распространенностью менее 10 человек на 100 000 населения.
Основная цель организации - помощь пациентам с редкими заболеваниями реализовать свое конституционное право на лечение, своевременную диагностику, реабилитацию и социальную поддержку.
Всероссийское общество редких (орфанных) заболеваний является членом рабочей группы по редким болезням Всероссийского Союза пациентов (ВСП), членом Совета по защите прав пациентов при МЗ РФ. Всероссийское общество редких (орфанных) заболеваний имеет соглашение о сотрудничестве с Росздравнадзором. Оказывает поддержку и юридическую помощь семьям, столкнувшимся с редким заболеванием.
Разделяете нашу позицию - поддержите нас
| ИНН/КПП | 7714400977 / 774301001 |
| ОГРН, ОКПО | 1127799005080, 09150445 |
| Полное наименование банка | ОАО "СБЕРБАНК РОССИИ" |
| Адрес банка | 117997, г. Москва, ул. Вавилова, д.19 (Доп. офис 9038/1577) |
| БИК | 044525225 |
| Корр. счет | 30101810400000000225 |
| Расчетный счет | 40703810838060072660 |
| Назначение платежа | Благотворительное пожертвование на ведение уставной деятельности Общероссийской общественной организацией "Всероссийское общество редких (орфанных) заболеваний" |
Часто задаваемые вопросы
Ответы на наиболее частые вопросы пациентов с МПН подготовила Ирина Николаевна Суборцева, к.м.н., старший научный сотрудник стандартизации методов лечения НМИЦ гематологии МЗ РФ.
Клетки крови появляются и поступают в сосуды из разных органов. Пока ребенок развивается в утробе матери, они образуются в печени, селезенке и костном мозге. После рождения клетки крови в основном производятся костным мозгом. Все клетки крови по происхождению делятся на лимфоциты и миелоциты (в каждой группе есть несколько подвидов). Отличия их в том, что лимфоциты после рождения в костном мозге проходят еще дополнительное «обучение» в лимфатических узлах и селезенке, а миелоциты всю необходимую информацию для их жизни и действий получают сразу в костном мозге. Изменившиеся, неправильные лимфоциты, а именно лимфоидные клетки, вызывают те или иные виды лимфопролиферативных болезней - лимфом. Неправильные миелоциты тоже могут вызывать болезни, которые называются миелопролиферативными (миело – обозначает «костный мозг», а пролиферация – «размножение»). Миелопролиферативные заболевания бывают острые и хронические. Острые заболевания протекают быстро, они агрессивно поражают организм. Хронические миелопролиферативные заболевания характеризуются медленным течением. Хронические миелопролиферативные заболевания - группа болезней (7 форм) с различными клиническими проявлениями, прогнозом. Три заболевания традиционно объединяют вместе из-за общих признаков. Эти три заболевания часто называют «классическими», «отрицательными по химерному гену BCR-ABL» и «отрицательными по филадельфийской хромосоме». Это следующие заболевания: истинная полицитемия, эссенциальная тромбоцитемия, первичный миелофиброз. Это тяжелые болезни, потенциально смертельные и неизлечимые. Но, с другой стороны, их течение медленное и относительно доброкачественное, что позволяет поддерживать качество жизни. Пациенты с миелопролиферативными заболеваниями подвержены риску возникновения тромбозов и кровотечений, а также есть риск развития острого лейкоза на фоне основного заболевания и его лечения. Точный диагноз может поставить только гематолог после проведенного обследования.
Причины возникновения хронических миелопролиферативных заболеваний достоверно неизвестны. Важную роль играют генетические мутации. Миелопролиферативные заболевания относятся к так называемым «клональным заболеваниям». Клональное заболевание начинается с одного или нескольких изменений в ДНК одной единственной стволовой клетки в костном мозге. Недифференцированная стволовая клетка, которая называется также гемопоэтической стволовой клеткой, представляет собой незрелую клетку крови, которая может превратиться в один из трех клеточных элементов крови: эритроцит, лейкоцит или тромбоцит. Изменения в ДНК незрелой (гемопоэтической) стволовой клетки заставляют ее непрерывно делиться, благодаря чему образуется все больше патологических стволовых клеток, которые созревают и превращаются в один или несколько типов клеточных элементов крови. В большинстве случаев причина, вызвавшая мутацию ДНК в стволовой клетке, остается неизвестной. Мутации могут быть вызваны как факторами окружающей среды, так и ошибкой, возникшей во время деления клеток. Хотя сообщалось о случаях возникновения истинной полицитемии, эссенциальной тромбоцитемии и первичного миелофиброза у нескольких членов одной семьи, они не относятся к наследственным заболеваниям. Они возникают из-за мутаций в генах, возникающих на протяжении жизни пациента. Такие мутации называются приобретенными (или соматическими). Кроме того, определенное значение имеет и временной фактор – с возрастом вероятность появления этого заболевания достоверно возрастает.
Тромбоцитоз (повышенное число тромбоцитов в общем анализе крови) опасно риском развития тромбозов и кровотечений.
Образование тромбов (сгустков крови) может привести к возникновению разных потенциально серьезных осложнений:
- Инсульт. Инсульт возникает, когда тромб блокирует приток крови к участку мозга. Нарушение притока крови к мозгу приводит к повреждению мозговой ткани. Признаки инсульта включают головокружение, потерю чувствительности, мышечную слабость в одной половине тела, нарушение активной речи, письма и способности воспринимать чужую речь.
- Транзиторная ишемическая атака. Если тромб образуется в артерии, по которой кровь поступает к головному мозгу, то это может вызвать временное прекращение притока крови к участку мозга. Проявления транзиторной ишемической атаки: головные боли, головокружение, слабость или онемение половины тела, нечеткость зрения или двоение в глазах, неразборчивая, невнятная речь.
- Инфаркт миокарда. Инфаркт миокарда возникает, когда тромб блокирует приток крови к сердцу.
- Осложнения течения беременности. Высокий тромбоцитоз у беременных может приводить к выкидышу, преждевременным родам и преждевременной отслойке плаценты (преждевременному отделению плаценты от стенки матки).
- Другие проявления, вызванные тромбоцитозом. Жгучая или пульсирующая боль в кистях или ступнях, обусловленная нарушением кровотока (этот симптом называется «эритромелалгия»).
В ряде случаев при высоком тромбоцитозе могут наблюдаться кровотечения. Данное состояние представляет собой феномен - тромбоцитемической парадокс. Изучение данного феномена позволило выяснитьь, что при очень высоком содержании тромбоцитов в кровь выделяется большое количество ферментов. Данные ферменты разрушают белки, которые принимают участие в формировании сгустка крови. Клинические проявления кровотечения могут включать: образование синяков (кровоподтеков) от легкого воздействия, носовые кровотечения, кровотечения из желудочно-кишечного тракта, кровь в каловых массах, кровь в моче.
Симптомы у каждого пациента субъективны, поэтому для их унификации созданы специальные опросники, позволяющие оценить качество жизни, охарактеризовать наличие и выраженность определенных симптомов, а также определить уровень физической ¬активности больного. Опросники необходимы для оценки клини¬ческого течения миелопролиферативных заболеваний, являются инструментом для подбора терапии для практической оценки ответа на проводимое лечение. МПН-10 представляет собой разработанный специально для больных хроническими миелопролиферативными заболеваниями опросник, которыйсостоит из 10 вопросов и охватывает наиболее частые симптомы, которые нужно охарактеризовать по 10-балльной шкале.
При выполнении молекулярно-генетических исследований, производится анализ тех или иных генов, что позволяет выявлять нарушения или мутации в данных генах. Высокочувствительный молекулярно-генетический анализ важен для более точной диагностики заболеваний, а также для многих других целей. Молекулярно - генетические анализы представляют собой очень чувствительные методики. В диагностические критерии миелопролиферативных заболеваний Всемирной организации здравоохранения 2016 года было включено проведение молекулярного анализа. С целью исключить хронический миелоидный лейкоз всем больным с подозрением на миелопролиферативное заболевание должно быть выполнено исследование BCR/ABL p210 (p230; p190). Мутация V617F в гене JAK2 обнаруживается у более чем 90% пациентов с истинной полицитемией. Мутация в экзоне 12 гена JAK2 обнаруживается у 2–3% пациентов с истинной полицитемией. При обоснованном подозрении на истинную полицитемию, но при отсутствии мутации V617F в гене JAK2 пациент должен быть проверен на наличие мутации в экзоне 12 гена JAK2. Необходимо исследовать мутации в генах JAK2, CALR и MPL при подозрении на наличие первичного миелофиброза и эссенциальной тромбоцитемии. Если у пациента нет ни одной из этих мутаций, врач может провести анализ на другие редко встречающиеся мутации.
Аспирация и трепанобиопсия применяются для изучения клеток костного мозга и обычно выполняются одновременно. Образцы костного мозга обычно получают из тазовой кости пациента после обезболивания места пункции. Для получения аспирата костного мозга в губчатое вещество тазовой кости вводится полая игла, через которую получают жидкий образец костного мозга, содержащий клетки. Для выполнения биопсии костного мозга используется более толстая игла, с помощью которой получают маленький кусочек кости, содержащий костный мозг. Вся процедура занимает несколько минут. Проводят ее под местной анестезией. Последствий после нее нет, поэтому нет необходимости оставаться в медицинском учреждении после манипуляций.
Образцы изучаются под микроскопом для выявления и подсчета количества патологических клеток, а также обнаружения рубцовой (фиброзной) ткани в костном мозге. При ИП в костном мозге обнаруживается повышенное количество клеток крови, а также повышенное количество клеток предшественников тромбоцитов, которые называются мегакариоцитами. У пациентов с ЭТ выявляется повышенное количество клеток-предшественников тромбоцитов в костном мозге (мегакариоцитов). Размеры и форма этих мегакариоцитов могут быть патологически изменены. У пациентов с МФ повышено количество мегакариоцитов с патологически измененными формой и размерами, а также отмечается разрастание соединительной ткани (фиброз) в костном мозге. У некоторых пациентов с МФ при аспирации не удается получить образец жидкой части костного мозга из-за фиброзных изменений. Из-за разрастания соединительной ткани при попытке аспирации материал костного мозга в иглу не поступает (так называемая «сухая пункция»), что указывает на отсутствие в нем клеток.
Любое хирургическое вмешательство – это всегда риск. И не стоит об этом забывать, даже проводя трепанобиопсию. Вероятность появления осложнений крайне низкая – 0,01%. Самые распространенные осложнения после процедуры – болезненность в месте проведения процедуры и крайне редко кровотечение. Для того чтобы обезопасить себя, пациентам, которые на время проведения забора принимают препараты, разжижающие кровь, врачи советуют отказаться от них на какое-то время.
Первичный миелофиброз представляет собой хроническое заболевание, которое уменьшает продолжительность жизни. Ожидаемая продолжительность жизни оценивается с помощью прогностических шкал (IPSS, DIPSS или DIPSS plus). Данные шкалы используются как при диагностике, так и при наблюдении за больными, в процессе лечения. В данных шкалах каждый признак, определяющий неблагоприятный исход, оценивается как балл. По сумме баллов пациента относят в группу (низкий риск/ промежуточный-1 риск/ промежуточный-2 риск/ высокий риск). Ожидаемая продолжительность жизни у пациентов группы низкого риска – более 15 лет, в то время как у пациентов группы высокого риска - 1,5 года. Это данные международных исследований. Однако ответить на вопрос о продолжительности жизни в каждом конкретном случае очень сложно. Некоторые пациенты после установления диагноза живут еще несколько десятилетий. Важно понимать, что сведения по исходам данного заболевания отражают усредненные данные по результатам лечения пациентов с МФ из разных групп риска и не позволяют дать точный прогноз в отношении индивидуальных случаев. Многое зависит от самого пациента (соматическое состояние, сопутствующие заболевания, психологический настрой, приверженность к лечению и выполнению всех рекомендаций). По этой причине пациентам рекомендуется обсудить информацию о своем прогнозе при этом заболевании со своими врачами.
Решение о беременности принимает пациентка. Только пациентка несет ответственность за данное решение. В настоящее время диагноз первичный миелофиброз не является абсолютным противопоказанием для планирования беременности. Во время беременности имеет место риск невынашивания. Как правило, во время беременности риск образования тромбов повышается, а беременные с миелопролиферативными заболеваниями особенно предрасположены к тромбообразованию. По причине рисков для развивающегося плода многие препараты, применяющиеся для лечения миелопролиферативных заболеваний, включая гидроксимочевину и анагрелид, во время беременности не назначают. Беременным для профилактики образования тромбов могут назначаться аспирин в низких дозах или низкомолекулярные гепарины, поскольку лечение этими препаратами сопровождается меньшей вероятностью побочных эффектов, опасных для плода. Если во время беременности количество тромбоцитов становится слишком высоким (например, ≥1000 x109 /л), или в случае возникновения кровотечения, можно достаточно безопасно назначать интерфероны. Гематолог, лечащий пациентку, должен обсудить с ее акушером-гинекологом наиболее оптимальное время отмены терапии перед родами. После рождения ребенка врач может рекомендовать ежедневное введение гепарина в течение нескольких недель для профилактики тромбоза глубоких вен. По данным литературы и собственным наблюдениям беременность не ухудшает течение заболевания. Однако в настоящее время не проводились крупные рандомизированные клинические исследования о влиянии беременности на течение болезни. Кроме того, следует помнить, что первичный миелофиброз является заболеванием при котором продолжительность жизни снижена.
Пациенты с миелопролиферативными заболеваниями должны тщательно следить за своим здоровьем. Образ жизни, сохраняющий здоровье, может способствовать снижению риска осложнений. Рекомендуемые изменения образа жизни:
- Отказаться от курения. Пациентам следует прекратить курить, поскольку никотин вызывает сужение кровеносных сосудов, что повышает риск возникновения инфаркта миокарда и инсульта.
- Стремиться достичь здорового веса тела. Избыточный вес тела или ожирение увеличивает риск возникновения повышенного артериального давления, сахарного диабета 2-го типа и ишемической болезни сердца.
- Принимать лекарства. Некоторым пациентам могут требоваться лекарства для снижения артериального давления, уровня холестерина и контроля течения сахарного диабета. Контроль этих заболеваний позволяет снизить риск возникновения инфаркта миокарда и инсульта.
- Выполнять физические упражнения. Умеренная физическая нагрузка, например пешие прогулки, улучшает кровоснабжение тканей и органов, снижая риск образования тромбов. Выполнение упражнений на растяжку ног и голеностопных суставов также может улучшать кровоснабжение и препятствовать формированию тромбов в венах ног. Врач или физиотерапевт могут составить для вас комплекс упражнений. Однозначно противопоказаны силовые упражнения (занятия в тренажерном зале). Во время физической нагрузки употребление жидкости должно быть адекватным.
Имплантация может быть проведена в период стабилизации хронического миелопролиферативного заболевания при отсутствии симптомов. Опасность заключается в развитии кровотечения, плохом заживлении раны и неприживлении импланта. Таким образом, очень важно, чтобы стоматолог согласовывал свои действия с гематологом (врачом, который следит за течением миелопролиферативного заболевания), поскольку стоматолог может не знать о повышенном риске кровотечений у данного пациента. Перед проведением лечения у стоматолога рекомендуется снизить количество эритроцитов и тромбоцитов до нормальных значений. Кроме того, план лечения должен включать меры по минимизации риска чрезмерного кровотечения.
Кровопускания выполняются большинству пациентов с истинной полицитемией с регулярными интервалами. Частота проведения кровопусканий индивидуальна. Назначает данную процедуру врач. Целью является поддержание гематокрита менее 45%. Кровопускания выполняются так же, как забор донорской крови из вены. Кровопускание снижает количество клеточных элементов крови и уменьшает объем крови. После данной процедуры кровь становится менее густой и уменьшается риск образования скоплений клеток крови вдоль стенок кровеносных сосудов. Сразу после кровопускания отмечается уменьшение некоторых симптомов болезни, таких как головные боли, звон в ушах и головокружение. В отдаленной перспективе поддержание гематокрита на целевом уровне позволяет снизить риск тромботических осложнений у больных истинной полицитемией. Процедура проводится только под контролем гематокрита. Число эритроцитов и гематокрит принимаются во внимание. Существует мнение, что кровопускание противопоказано при тромбоцитозе более 1000 Х109/л. Однако клинических исследований не проводилось. Проводить кровопускание бесконечно невозможно - со временем регулярные процедуры приводят к дефициту железа в организме. О резистентности (неэффективности) кровопусканий свидетельствует потребность более чем в 3 сеансах в год. При неэффективности кровопусканий следует рассмотреть вопрос медикаментозного лечения.
Альтернативой кровопусканиям является гирудотерапия, хиджама или проведение эритроцитофереза. Альтернативой кровопусканиям является гирудотерапия, хиджама или проведение эритроцитофереза.
Возможность хирургического удаления селезенки (спленэктомия) рассматривается в случаях, когда другие методы лечения не способны уменьшить боль или справиться с осложнениями, связанными с увеличением селезенки. Необходимо тщательно взвесить пользу и риск этой процедуры. Польза состоит в облегчении симптомов, уменьшении портальной гипертензии (давления в портальной вене), а также в снижении потребности в переливаниях эритроцитов. Возможные риски этой процедуры включают кровотечения, образование тромбов, инфекции, увеличение печени и повышение количества тромбоцитов.
В настоящее время хронические миелопролиферативные заболевания являются неизлечимыми болезнями. Аллогенная трансплантация стволовых клеток рассматривается как единственный метод, позволяющий добиться излечения пациентов с первичным миелофиброзом, но при этом характеризуется высоким риском побочных эффектов, угрожающих жизни. Проведение аллогенной трансплантации стволовых клеток не показано больным истинной полицитемией и эссенциальной тромбоцитемией вследствие высокого риска смерти во время проведения трансплантации. При проведении этой процедуры пациент получает высокие дозы химиотерапевтических препаратов или облучения с целью уничтожения пораженного костного мозга. Затем пациенту путем внутривенного переливания вводят здоровые кроветворные (гемопоэтические) стволовые клетки от совместимого донора (родственного или неродственного, имеющего совместимые стволовые клетки). Трансплантированные здоровые клетки донора переходят в костный мозг пациента, замещая его дефектные стволовые клетки. Новые клетки размножаются и созревают, образуя здоровые эритроциты, лейкоциты и тромбоциты. Аллогенную трансплантацию стволовых клеток, как правило, рискованно проводить пожилым пациентам и пациентам, имеющим сопутствующие заболевания. По этой причине ее рекомендуется проводить молодым пациентам, у которых нет сопутствующих проблем со здоровьем. Возможность проведения трансплантации определяется медицинскими показаниями, состоянием больного и наличием донора. Вопрос о том, является ли трансплантация стволовых клеток возможным методом лечения для конкретного пациента, следует обсудить с лечащим врачом.
Побочные эффекты лечения гидроксимочевиной зависят от многих факторов, в том числе от дозы препарата, возраста пациента и сопутствующих заболеваний. В целом, терапия гидрокстмочевиной хорошо переносится. Нежелательные явления регистрируются у 1/3 больных. Лечение может сопровождаться повышенной утомляемостью, может появиться тошнота, лихорадка, озноб, головокружение, одышка, временная потеря волос и другие побочные эффекты. При длительном лечении имеется риск появления язв на слизистых и коже. Очень важно отслеживать и устранять побочные эффекты. Критерии неэффективности и непереносимости терапии гидроксимочевиной четко определены, поэтому пациентам следует обсудить с врачом любые вопросы и проблемы, связанные с побочными эффектами, со своим врачом. Большинство побочных эффектов преходящие.
Резистентность к гидроксимочевине развивается у 11 – 15% пациентов при длительности терапии 6 - 7 лет. Резистентность представляет собой отсутствие контроля за заболеванием при лечении гидроксимочевиной в адекватной дозировке (2000 мг (4 капсулы) в сутки). Длительность лечения составляет не менее 3 месяцев. Появление гематологических нежелательных явлений (снижение числа тромбоцитов менее 100 Х 109/л, снижение гемоглобина менее 100 г/л, снижение лейкоцитов менее 4 Х 109/л) также рассматривается как неудача лечения.
Таргетной называют терапию при которой лекарственные препараты воздействуют на определенные мишени (цели). В настоящее время для лечения хронических Ph-негативных миелопролиферативных заболеваний зарегистрирован только один таргетный препарат – руксолитиниб. Руксолитиниб является ингибитором киназ JAK1/JAK2. Выпускается в виде таблеток для приема внутрь. Белки-киназы семейства JAK посылают сигналы, влияющие на выработку клеток крови в костном мозге. Если JAK-киназы посылают слишком много сигналов, то в организме образуется избыток клеточных элементов крови. Руксолитиниб ингибирует JAK-белки и подавляет чрезмерную стимуляцию костного мозга. Он одобрен для лечения пациентов с миелофиброзом промежуточного или высокого риска, в том числе первичного миелофиброза, вторичного постполицитемического и посттромбоцитемического миелофиброза и для лечения пациентов с истинной полицитемией при неэффективности / непереносимости первой линии терапии.
В настоящее время руксолитиниб является единственным зарегистрированным таргетным препаратом, ингибитором JAK2. Это эффективное лекарственное средство для лечения больных миелофиброзом, в т. ч. первичным и вторичным, развившемся вследствие эссенциальной тромбоцитемии и истинной полицитемии, а также для лечения больных истинной полицитемией. Руксолитиниб (Джакави) включен в перечень жизненно необходимых и важнейших лекарственных препаратов РФ.
Наиболее значимым побочным эффектом является синдром «цитокиновой отдачи», выражающийся в быстром возврате симптомов интоксикации, вплоть до системной воспалительной реакции и спленомегалии, развивающийся после отмены препарата. Поэтому самостоятельно, по собственному желанию, отменять руксолитиниб нельзя. При необходимости отмены препарата / перерыва в лечении, следует постепенно снижать дозировку препарата, в ряде случаев требуется назначение глюкокортикостероидов (преднизолон). Возможно это только под контролем гематолога.
Начальная доза препарата зависит от числа тромбоцитов: 50–100×109/л – по 5 мг 2 раза в сутки; 100–200×109/л – по 15 мг 2 раза в сутки; > 200×109/л – по 20 мг 2 раза в сутки. В начальной дозе лечение проводят в течение 4 недель. Дальнейшую дозу подбирают индивидуально с учетом переносимости и эффективности. В случае снижения числа тромбоцитов меньше 50×109/л лечение приостанавливают. Однако следует ориентироваться не только на число тромбоцитов, но и на наличие геморрагического синдрома. Возобновляют терапию в дозе 5 мг 2 раза в сутки после повышения числа тромбоцитов/нейтрофилов выше указных показателей. Далее дозу при необходимости постепенно повышают, тщательно контролируя число форменных элементов крови. При уменьшении количества тромбоцитов меньше 100×109/л рекомендуется снизить дозу, чтобы избежать перерыва в лечении вследствие развившейся тромбоцитопении. В случае необходимости и при условии, что число тромбоцитов и нейтрофилов является достаточным, дозу препарата можно увеличивать максимум на 5 мг 2 раза в сутки не чаще чем раз в 2 недели. Максимально допустимая суточная доза – 50 мг: по 25 мг 2 раза в сутки.
Наиболее частыми побочными эффектами, выявленными в ходе клинических исследований, являются анемия и тромбоцитопения. Гематологические нежелательные явления: снижение гемоглобина – в 80% наблюдений, тромбоцитопения - у 2/3 больных. Эти реакции носят дозозависимый характер.
Абсолютное число форменных элементов крови следует контролировать каждые 2–4 недели в период титрования дозы препарата и далее по клиническим показаниям. При развитии анемии может потребоваться переливание эритроцитной массы пациенту и коррекция дозы препарата. На 8–12 неделе лечения показатель гемоглобина достигает максимально низкого уровня. В дальнейшем он постепенно повышается и сохраняется на уровне на 10 г/л ниже исходного (до начала терапии). Такая тенденция наблюдается у пациентов вне зависимости от того, получают ли они гемотрансфузию во время лечения.
У многих пациентов с миелопролиферативными заболеваниями возникает зуд кожи, который причиняет выраженное неудобство. Для профилактики зуда рекомендуется реже принимать ванну; также рекомендуется купаться в прохладной воде и пользоваться мягким мылом. Пациентам также рекомендуется не принимать горячую ванну, джакузи или душ. Также очень важно постоянно увлажнять кожу лосьоном и стараться не чесать ее, чтобы не повредить. Антигистаминные препараты могут помочь снизить интенсивность постоянного зуда. Побочные эффекты антигистаминных препаратов включают сухость во рту, сонливость, головокружение и беспокойство. Седативные препараты, анксиолитики позволяют лучше переносить интенсивный кожный зуд после водных процедур. Также для лечения зуда используется светотерапия (фототерапия) с применением лекарства под названием псорален в комбинации с ультрафиолетом А. Патогенетического средства лечения аквагенного кожного зуда нет. Единственный эффективный метод купирования кожного зуда – лечение основного заболевания (цитостатическая терапия, руксолитиниб). Следует отметить, что препараты интерферона могут приводить к усилению выраженности кожного зуда.
Что делать, когда диагноз установлен
Шаг 1. Собрать документы:
- Выписки из медицинского учреждения, с указанием диагноза, рекомендуемого лечения.
- Оформление инвалидности
Шаг 2:
- Передача пакета документов лечащему врачу.
- Проведение врачебной комиссии по месту жительства в заключении которой должно быть подтверждена необходимость назначения ферментной заместительной терапии.
Шаг 3:
Обратиться с приложением пакета документов в органы здравоохранения региона для решения вопроса о закупки препарата
Шаг 4:
Обратиться в общественную организацию, приложить письма в органы здравоохранения, медицинские документы с просьбой помочь в лекарственном обеспечении пациента
Шаг 5:
Если вы получили отказ, то следует написать письмо в министерство здравоохранения РФ, обсуждать дальнейшие действия с представителями общественной организации